第二章 溶液热力学
1 偏摩尔量及其物理性质
- 广度性质(容量性质)和强度性质的区别
广度性质可以加和,强度性质无法加和- 偏摩尔量是一个强度性质量因为在计算偏摩尔量时已经对n求导
- 组分的偏摩尔自由能即化学势是吉布斯自由能函数的偏摩尔量
- (img)
不重要 - 溶液的吉布斯自由能
- 集合公式:G-D公式(img)
恒定T、P下,溶液中个组分的偏摩尔吉布斯自由能(或其他偏摩尔量)的改变是相互制约、补偿的。
2 理想溶液与稀溶液
- 理想溶液:在全部浓度范围内服从拉乌尔定律的溶液
- 拉乌尔定律:恒温条件下平衡是i组元在气相中的分压pi与溶液中i组元的摩尔分数xi成正比
- 理想溶液的热力学性质
理想溶液的△Hm=0,△Vm=0
- 稀溶液:溶质服从亨利定律,溶剂服从拉乌尔定律
- (img)
物质在气相与液相中存在形态相同:i=\[i\],此时满足的是西特华定律- 亨利定律:溶液中i组元浓度趋近于0时,平衡后i组元在气相中的着呢起亚_pi_与溶液中i组元的摩尔含量_xi_呈线性关系
pi=Kh*xi - 稀溶液的热力学性质:
- 混合焓和浓度无关,是常量
- 熵变较(△Sm(R))有所变化
- 亨利定律:溶液中i组元浓度趋近于0时,平衡后i组元在气相中的着呢起亚_pi_与溶液中i组元的摩尔含量_xi_呈线性关系
- 真实溶液:溶液不满足拉乌尔定律
- 蒸气压于浓度
- 真实溶液在最后一点点(接近纯物质)时符合拉乌尔定律
- 蒸气压于浓度
- 纯物质与假想物质标准态
- 活度:浓度的修正
- 活度系数:修正系数rB,fB(H)
- 对拉乌尔定律呈现真偏差的溶液组元对亨利定律一定负偏差。反之亦然。
- 两个标准态转换
- 质量百分之一溶液标准态
- 此状态下对应的kH值,有可能存在也可能不存在
- 此状态下根据亨利定律计算蒸气压:
- 不同标准态的转化:

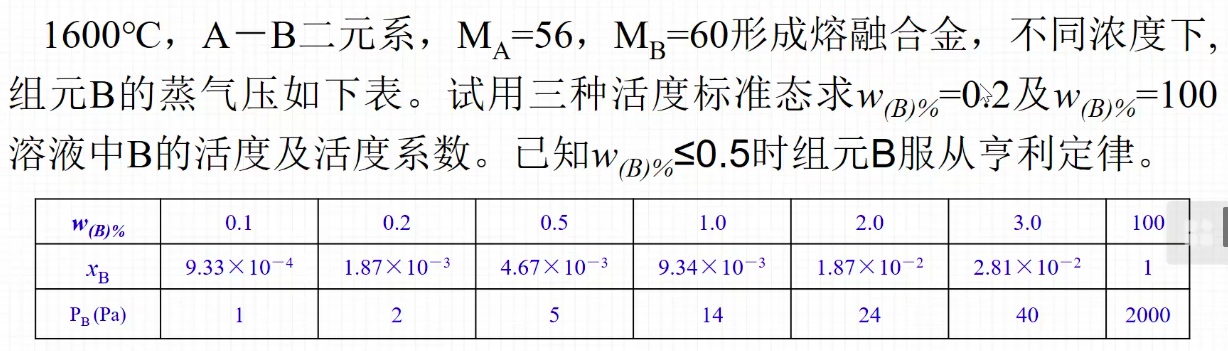
习题1
- 思路
- 质量百分含量转化为摩尔百分含量(wb转化为xb):
近似的可看作$\frac{Ma}{1}$ - 三种假设情况下进行计算:

- 答案
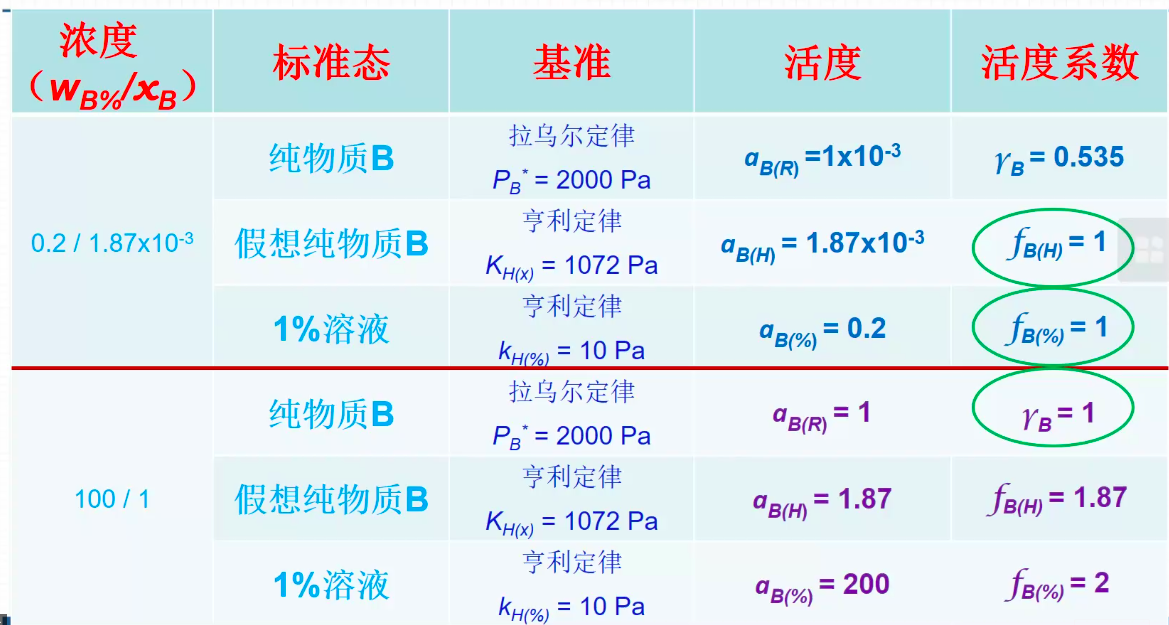
注意活度系数和活度的计算(要分假象情况来计算)
- 质量百分含量转化为摩尔百分含量(wb转化为xb):
活度标准态的选择
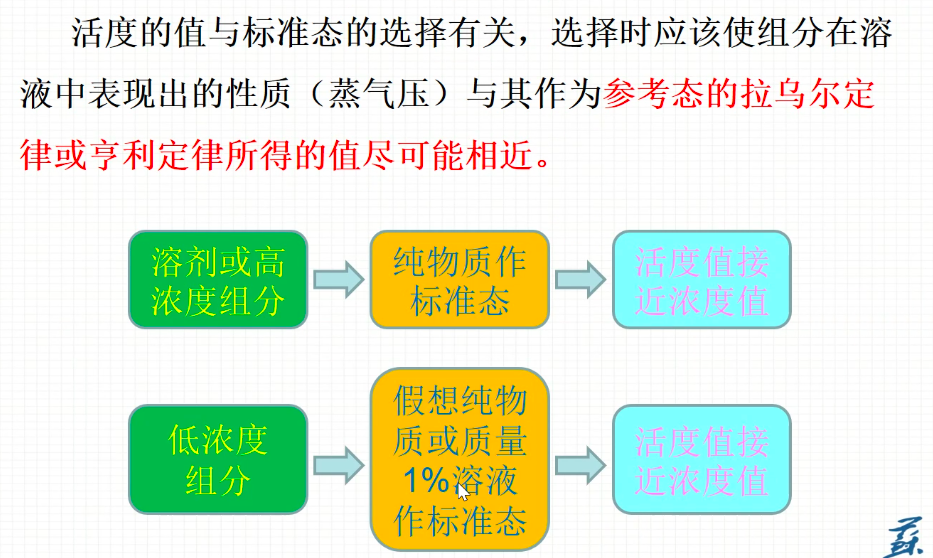
小结
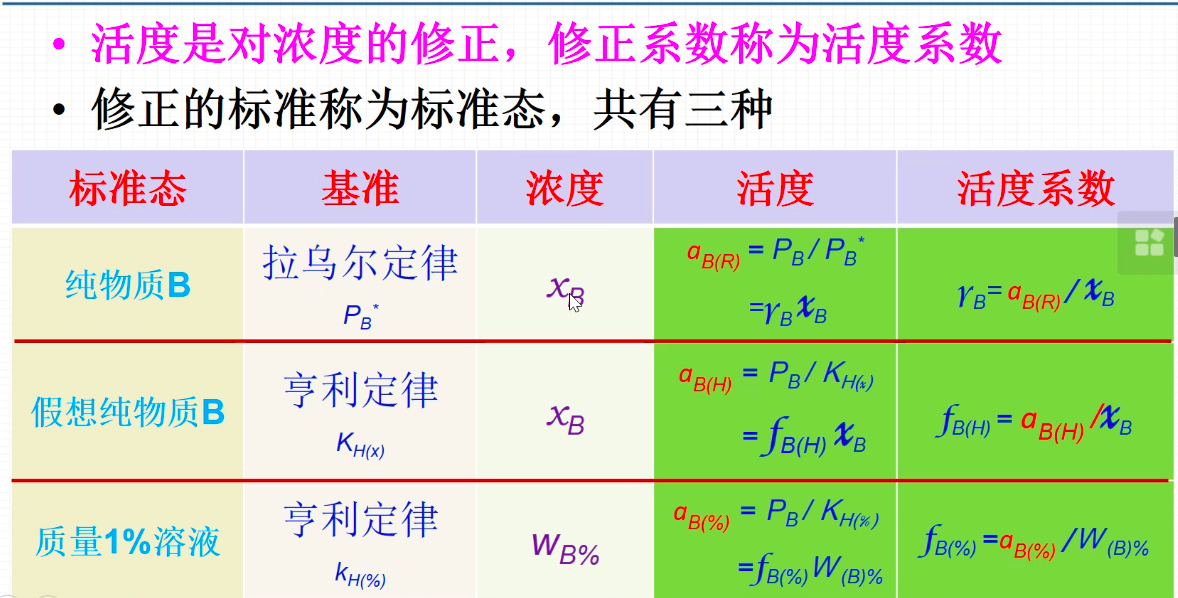
十分重要!!!!要理解
- 思考题:(下节课回答)

活度的测定及计算
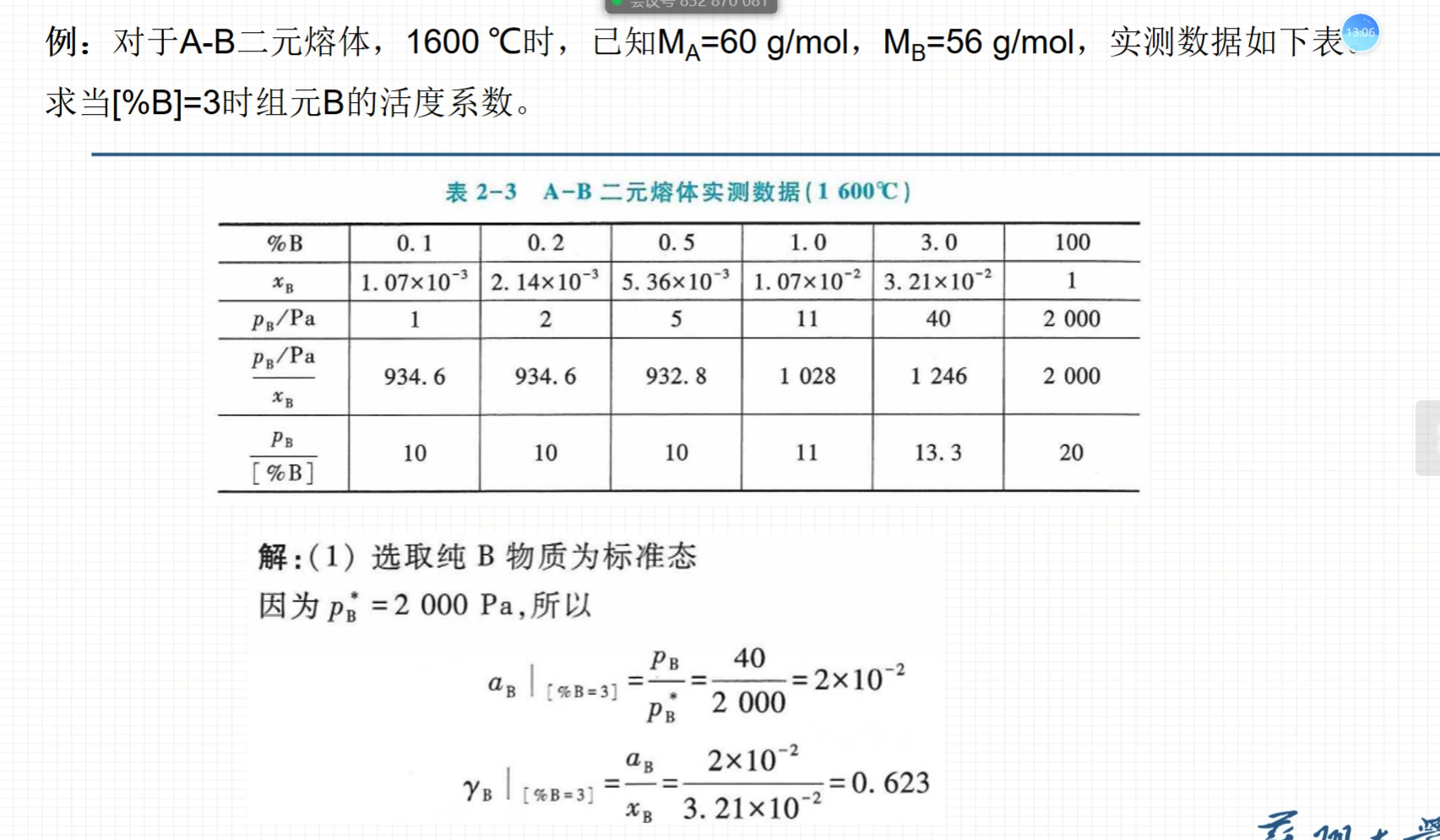
蒸汽压法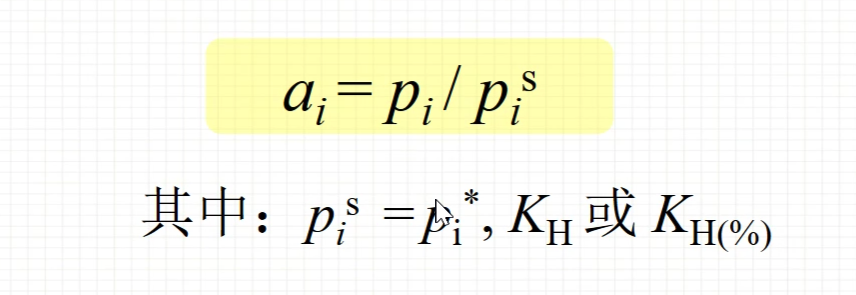
- 大多数情况不能用蒸汽压求。因为饱和蒸汽压是一个很低的值,不好测

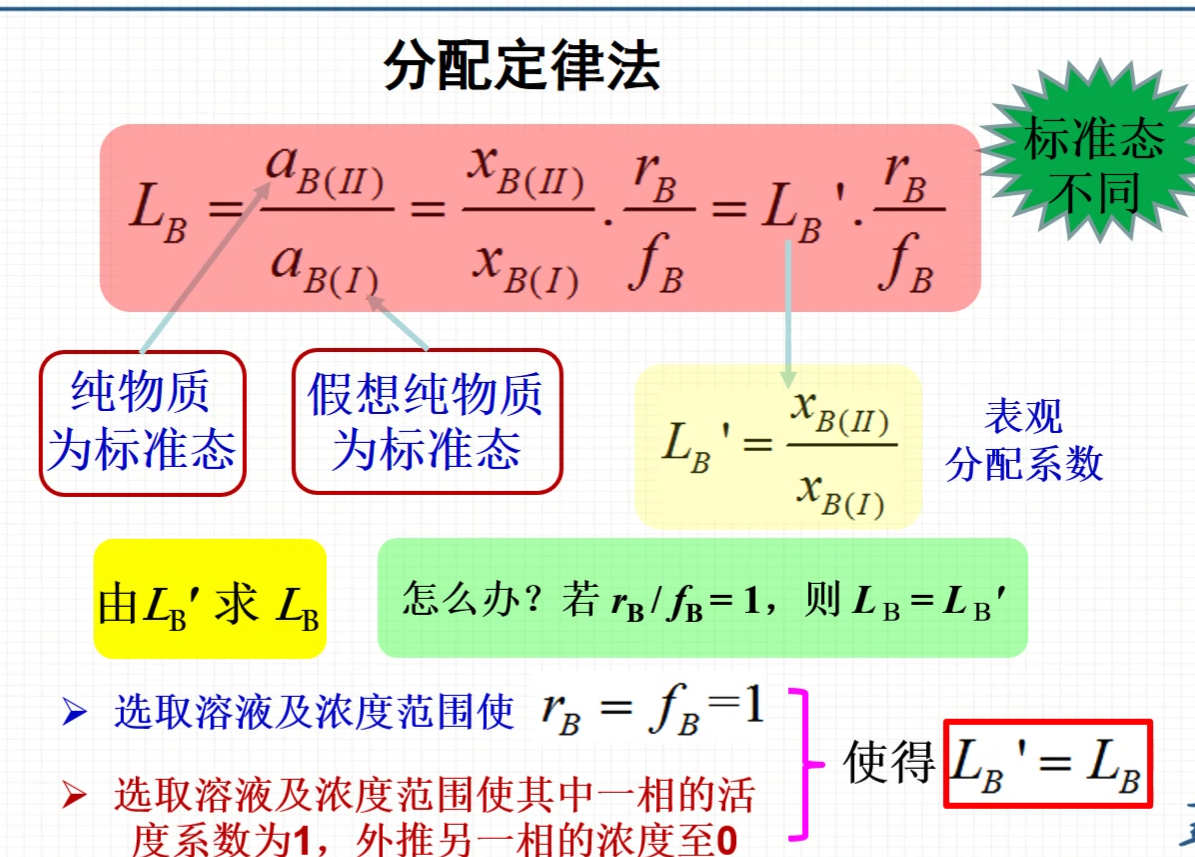
分配定律法
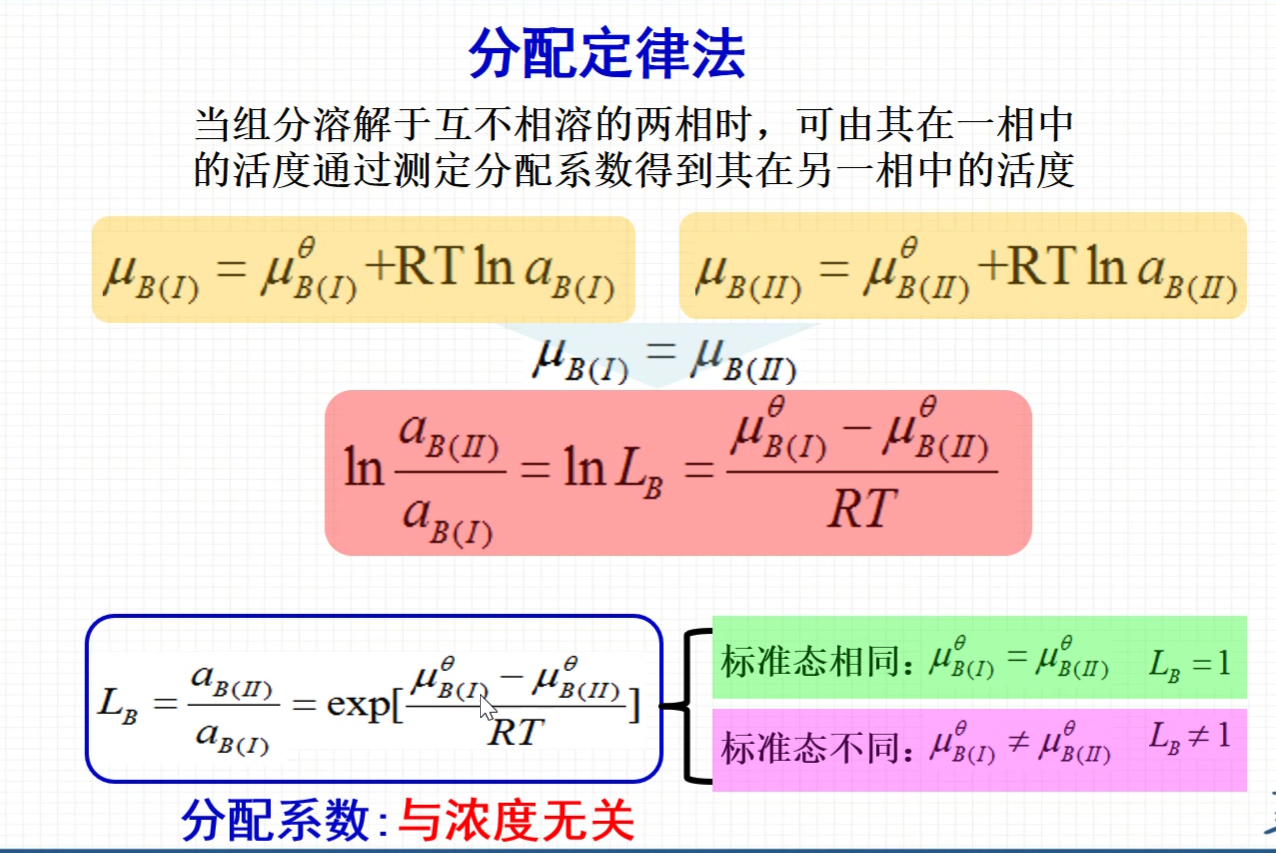

- Lb’是浓度之比,而不是之前的活度之比。此式子将活度之比转化为了浓度之比。求不出Lb,转而求Lb‘

- 如何由Lb’求Lb?
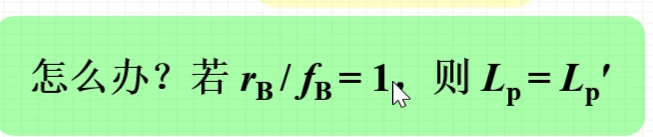
- 例题
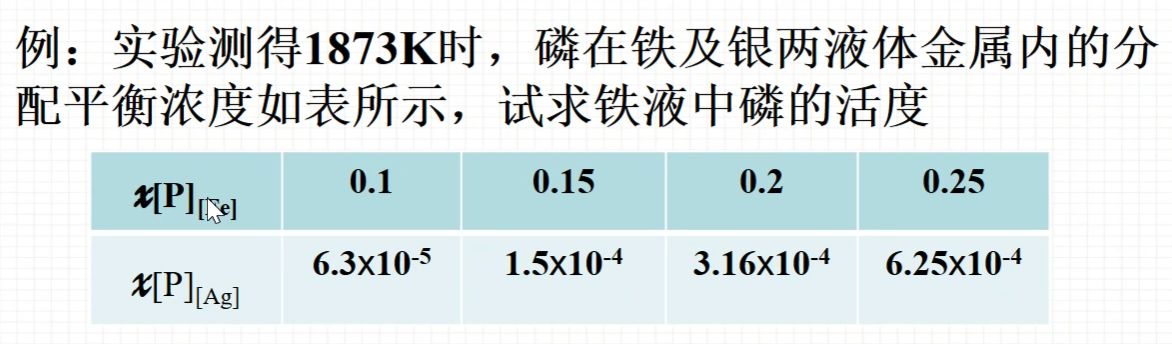
- 解答

- why处解答:为了创造之前说的条件,使得Lp=Lp’
- 例题

电动势测定法
G-D方程计算组分的活度
小结

- 第二个和第三个重要。题目基本上在这两个里面出